
1
背景介绍
细胞-细胞融合过程在神经传递、外排与内吞、信号传导与病毒感染等生物转化中起着关键作用。开发自组织功能细胞样的微/纳米容器,即原细胞(Protocells),是快速发展的“系统化学”领域的主要目标。不同的原始细胞内含物包括脂质体(liposomes)、聚合体(polymersomes)、树突体(dendrosomes)、蛋白质体(proteinsomes)、水微滴(aqueousmicrodroplets)和水凝胶微胶囊(hydrogelmicrocapsules)。通过这些组件的整合,细胞样环境中存在装配催化、光催化、和生物催化等反应。细胞样内含物的融合以及原始细胞内部与外部环境之间化学物质的交换产生了功能性微/纳米储库,揭示了细胞内编程的催化功能或用于治疗应用的功能性“智能”药物载体。同时,细胞外囊泡及其在细胞间传递核酸和蛋白质的生理功能越来越多引起人们的研究兴趣。特别是,研究集中于模拟天然系统的合成类似物的发展,并努力确定合成细胞外囊泡的临床应用。

论文导读

该研究报道了报告三种不同负载的脂质体逐步融合到集成的功能原始细胞模型系统。具体地说,研究者解决了逐步光和pH触发的核酸修饰脂质体的融合,在其中加入了休眠的、非活性的负载。存在于分离的脂质体中的成分,在融合后产生相互通信成分的集成合成细胞集合,允许生物催化级联操作和指示DNA类型的机械。该结果通过提供构建细胞样功能容器的方法,推进了快速发展的“合成细胞”领域。除了模拟自然过程的重要意义之外,该研究还证明了生物催化级联作为监测脂质体融合的工具的成功应用,以及在受限环境中为DNA机器的动态调制而设计纳米组件的手段。
三种核酸功能化脂质体以光和pH为触发点的逐步融合原理,以及融合过程的物理、光谱和成像方法如图1所示。
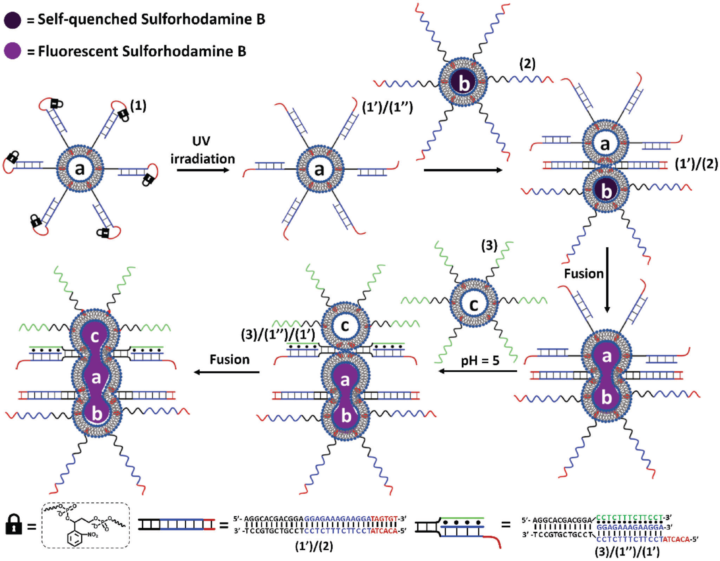
图1. 以光和pH为触发剂的三种脂质体(A)、(B)和(C)的逐步融合示意图。
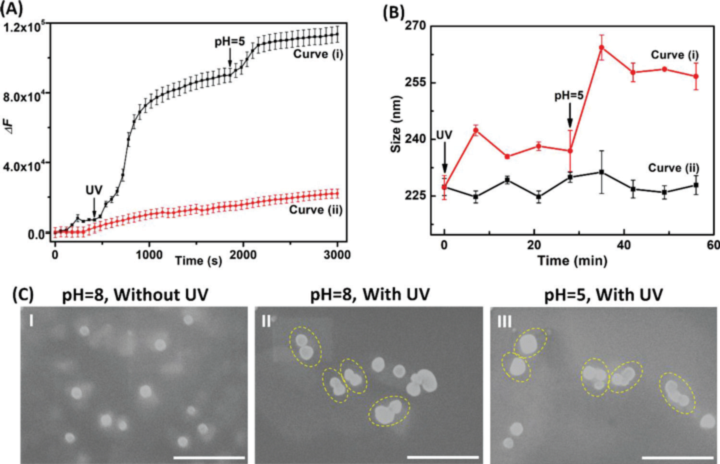
图2. 磺胺若丹明B的时间荧光变化
图2中的曲线(i)描述了脂质体(a)用(b)在pH = 5.0条件下,用(b)逐步照射(波长为365 nm),然后用脂质体(c)处理光融合脂质体(pH = 5.0)后脂质体系统的荧光变化。脂质体(a)和(b)在波长为365 nm时辐照,荧光增强,在≈1000 s后趋于稳定,这与脂质体的融合和荧光标记的稀释一致。用脂质体(c)进一步处理融合脂质体,进一步增强了磺胺嘧啶B标记的时间依赖性荧光变化,也达到饱和水平。脂质体中荧光标记的进一步增加与三种脂质体融合容器中荧光标记的融合引导稀释一致。值得注意的是,脂质体逐步融合后,对脂质体溶液进行色谱分离,探测其周围体积溶液中是否存在磺胺丹B。洗脱液中检测不到稀释后的荧光染料的荧光信号,从而消除了融合过程中染料泄漏的可能。此外,需要注意的是,硫磺胺B在融合第二步的荧光变化明显低于脂质体(a) + (B)的融合**步,这是由于荧光的非线性聚合染料稀释后的变化。
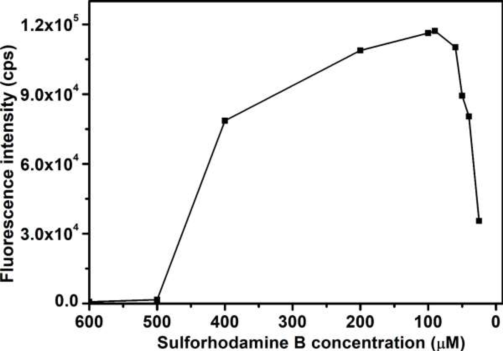
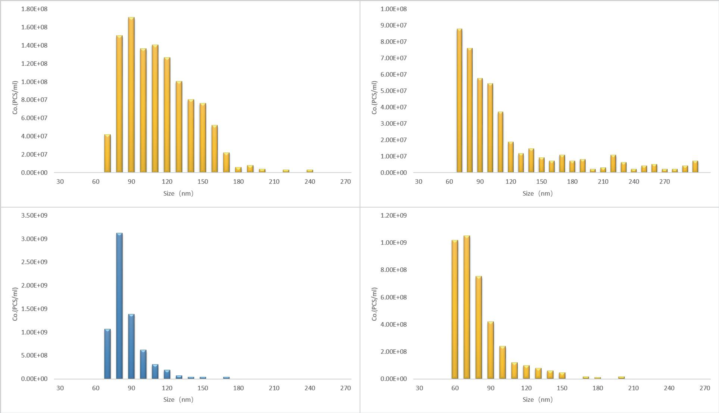
此外,图3展示稀释后磺胺B的非线性荧光变化。利用(a) + (b)和(a) + (b) + (c)融合脂质体的逐步大小变化,通过动态光散射(DLS)评估,淬灭的荧光团标记没有从脂质体中泄漏,可以估计融合后探针的稀释系数,并进一步评估两步融合过程中荧光变化的程度。通过这一过程,验证了图1曲线所示的淬灭荧光团探针的实验荧光变化,每一步的融合效率≈80-85%。已知脂质体的初始浓度和三脂质体的总体融合效率≈80-85%,我们估计融合的三脂质体的浓度为≈2.7×1012脂质体/mL,该值与NanoCoulter粒度仪装置评估的浓度一致(具体操作如下)。
脂质体的制备。将4 mM DOPC(二油酰基卵磷脂)、2 mM CHOL(胆固醇)加入10 mL圆底烧瓶中,溶于4 mL氯仿中。随后,将原液在氯仿中用氮气蒸发形成脂膜,并在旋转蒸发器下进一步干燥。脂膜用20 mM PBS(pH 7.0)水合,*终脂质浓度为4 mM。随后,使用注射器将混悬液重复通过包括0.22µm孔的滤膜(聚碳酸酯)21次,以形成脂质体混悬液。分别用60~200 nm或150~500 nm两种测量范围的金属纳米孔芯片在NanoCoulter(ResunTech, co., Shenzhen)纳米库尔特粒度仪上计算脂质体的平均粒径与数量(浓度)。
为了进行比较,图2A曲线(ii)描绘了在pH = 8.0下,脂质体(a)、(b)和(c)在不辐照的情况下逐步混合后的荧光变化。没有观察到荧光变化,这表明确实需要光诱导/ ph酸化脂质体的耦合动态融合来刺激脂质体混合物中的荧光变化。图1B描述了脂质体组合的时间尺寸变化,在它们使用光/pH触发融合时。单个脂质体(a)的平均尺寸为225±5 nm,而脂质体(a)和脂质体(b)的辐照量为365 nm,可使脂质体的平均尺寸扩大至240±5 nm。(a)/(b)融合脂质体与脂质体(c)在pH = 5.0条件下处理后,生成的脂质体结构尺寸为265±5 nm曲线(i)。与此同时,脂质体(a)与脂质体(b)依次处理,然后与脂质体(c)依次处理,在没有各自的融合触发器的情况下,导致脂质体的大小不变,曲线(ii),225±5 nm,证实没有发生融合。图1C描绘了脂质体在不同融合步骤下的形态变化所对应的SEM图像。脂质体(a)、(b)和(c)的混合物显示出直径约为200 nm的单个球形结构(图2)。尽管如此,荧光研究(图1A)和进一步的实验证实了相互作用的脂质体之间的负载交换,以及脂质体在连续光/pH触发下的支持大小和形状变化,将为三种脂质体的融合提供令人信服的证据。
通过葡萄糖氧化酶(GOx)-辣根过氧化物酶(HRP)级联在融合容器中成功运作,进一步证实了光/ ph诱导脂质体(a)、(b)和(c)的连续融合确实进行了,并导致了融合容器中负载的交换。研究者提供了通过脂质体-脂质体融合过程激活酶级联的简单模型,作为细胞-细胞融合引起的生物催化级联的模型。此外,进一步的融合脂质体引导的DNA机制也展示了融合脂质体原始细胞中mRNA的转录(详细内容可点击阅读原文下载获取)。
文中使用到的NanoCoulter—— 纳米库尔特粒度仪, 采用新一代库尔特原理的电学检测方法,粒径分辨率可达到1 nm。依次检测样本中每一个颗粒,实现真正意义上的纳米单颗粒检测,数据精度媲美电镜,一次测试可获得多维度颗粒表征数据(粒径、浓度、zeta电位、形态),为科学研究、生产品控、医药研发、疾病诊断等领域,提供精准支持;更加快速、**的助力病毒颗粒、脂质体、外泌体等细胞外囊泡、乳胶微球、纳米磁珠、无机纳米材料等的研究和表征质控。

脂质体应用案例
公司官网:
www.resunbio.com







